原子间的键合
1.当两个或多个原子形成分子或固体时,它们是依靠什么样的结合力聚集在一起的,这就是原子间的键合问题。原子通过结合键可构成分子,原子之间或分子之间也靠结合键聚结成固体状态。
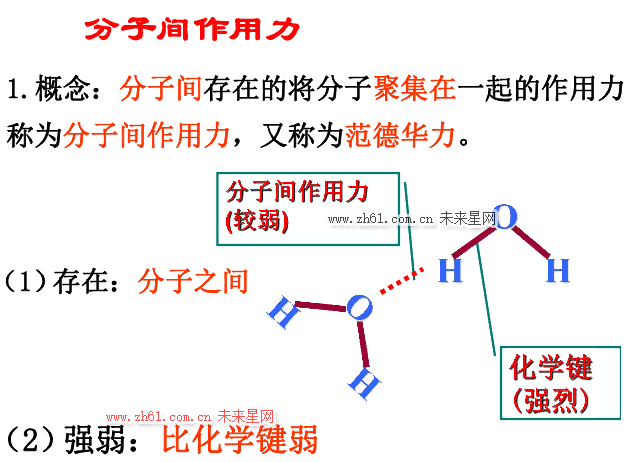
2.结合键可分为化学键和物理键两大类。化学键即主价键,它包括金属键、离子键和共价键;物理键即次价键,也称范德瓦耳斯力(也称范德华力)。此外,还有一种称为氢键的,其性质介于化学键和范德瓦耳斯力之间。
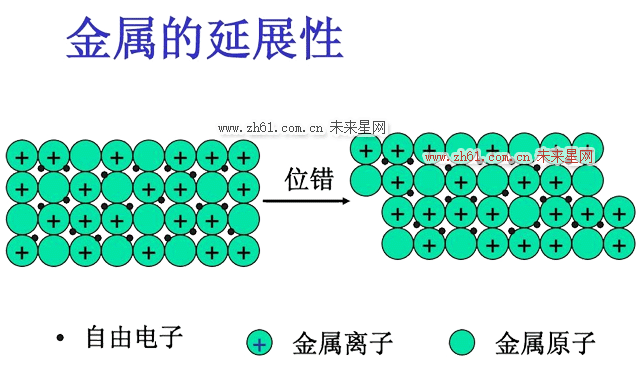
3.典型金属原子结构的特点是其最外层电子数很少,且原属于各个原子的价电子极易挣脱原子核的束缚而成为自由电子,并在整个晶体内运动,即弥漫于金属正离子组成的晶格之中而形成电子云。这种由金属中的自由电子与金属正离子相互作用所构成的键合称为金属键。绝大多数金属均以金属键方式结合,它的基本特点是电子的共有化。
4.由于金属键既无饱和性又无方向性,因而每个原子有可能与更多的原子相结合,并趋于形成低能量的密堆结构。当金属受力变形而改变原子之间的相互位置时不至于破坏金属键,这就使金属具有良好的延展性,并且,由于自由电子的存在,金属一般都具有良好的导电和导热性能。
5.大多数盐类、碱类和金属氧化物主要以离子键的方式结合。这种结合的实质是金属原子将自己最外层的价电子给予非金属原子,使自己成为带正电的正离子,而非金属原子得到价电子后使自己成为带负电的负离子,这样,正负离子依靠它们之间的静电引力结合在一起。故这种结合的基本特点是以离子而不是以原子为结合单元。离子键要求正负离子作相间排列,并使异号离子之间吸引力达到最大,而同号离子间的斥力为最小,故离子键无方向性和饱和性。因此,决定离子晶体结构的因素就是正负离子的电荷及几何因素。离子晶体中的离子一般都有较高的配位数。
6.一般离子晶体中正负离子静电引力较强,结合牢固。因此,其熔点和硬度均较高。另外,在离子晶体中很难产生自由运动的电子,因此,它们都是良好的电绝缘体。但当处在高温熔融状态时,正负离子在外电场作用下可以自由运动,此时即呈现离子导电性。
7.共价键是由两个或多个电负性相差不大的原子间通过共用电子对而形成的化学键。根据共用电子对在两成键原子之间是否偏离或偏近某一个原子,共价键又分成非极性键和极性键两种。
8.共价键晶体中各个键之间都有确定的方位,配位数比较小,共价键的结合极为牢固,故共价晶体具有结构稳定、熔点高、质硬脆等特点。由于束缚在相邻原子间的"共用电子对"不能自由地运动,共价结合形成的材料一般是绝缘体,其导电能力较差。
9.范德瓦耳斯力属物理键,系一种次价键,没有方向性和饱和性。它普遍存在于各种分子之间,对物质的性质,如熔点、沸点、溶解度等的影响很大,通常它的键能比化学键的小 1~2 个数量级,远不如化学键结合牢固。如将水加热到沸点可以破坏范德瓦耳斯力而变为水蒸气,然而要破坏氢和氧之间的共价键则需要极高的温度。注意,高分子材料的相对分子质量很大,其总的范德瓦耳斯力甚至超过化学键的键能,故在去除所有的范德瓦耳斯力作用前化学键早已断裂了。所以,高分子往往没有气态,只有液态和固态。
10.氢键是一种极性分子键,存在于 HF,H2O,NF3 等分子间。由于氢原子核外仅有一个电子,在这些分子中氢的唯一电子已被其他原子所共有,故结合的氢端就裸露出带正电荷的原子核。这样它将与邻近分子的负端相互吸引,即构成中间桥梁,故又称氢桥。氢键具有饱和性和方向性。
11.严格地讲氢键也属于次价键。因它也是靠原子(分子或原子团)的偶极吸引力结合在一起的。它的键能介于化学键与范德瓦耳斯力之间。氢键可以存在于分子内或分子间。氢键在高分子材料中特别重要,纤维素、尼龙和蛋白质等分子有很强的氢键,并显示出非常特殊的结品结构和性能。

 更多
更多
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底