泡利原理。洪特规则、能量最低原理这三大规则与之前在【002】中提到的构造原理不同,三大规则解决的问题并不是电子填入哪一个能级,而是电子在能级里面会发生怎样的行为。也就是之前我们只研究了电子排布式,例如铁 [Ar]3d^{6}4s^2 那么在 3d^6 中,这六个电子如何填充呢?是填满3个轨道,剩下两个轨道空着,还是平均占有5个轨道,剩下一个电子跑到一个轨道和另一个规则成对呢?要搞明白这个,我们首先要引入能量最低原理。
一、能量最低原理
在【003】中我们知道,基态是能量最低的状态,所以,基态原子的电子排布是能量最低的原子轨道组合,由此人们得出一条原理:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理。
所以,假如一个电子越过1s,直接从2s填起,我们就说这违背了能量最低原理。这个原理看上去很简单,却是整个物理学化学中很根基的东西,也是我们接下来要讲的两个原理的根基。
二、泡利不相容原理
1925年,泡利(Pauli)提出,在一个原子轨道里,最多只能容纳两个电子,它们的自旋方向相反(关于自旋请见【002】),这个原理被称为泡利原理。
下面我们来看看电子排布的轨道表达式(电子排布图),与电子排布式不同,轨道表达式更进一步地阐明了能级里面的电子是怎排布的,我们要讲的就是轨道表达式的规则:
1.用方框或圆圈表示原子轨道,能量相同的原子轨道(简并轨道)的方框相连;
2.箭头表示自旋状态的电子,箭头方向表示自旋状态;
3.通常应在方框下方或上方标记能级符号,有时画出的能级上下错落,以表达能量高低不同,
举例如图:
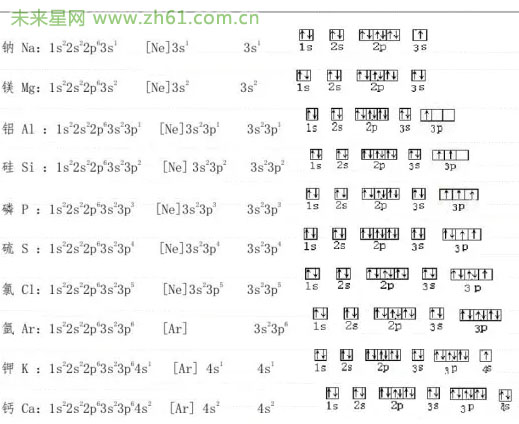
讲完了泡利原理和电子排布的轨道表示式,让我们进一步学习洪特规则。
三、洪特规则
洪特(Hunt)指出,在基态的原子或离子中,填入简并轨道的电子总是先单独分占,且自旋方向平行,称为洪特规则(如p轨道就是三重简并,s轨道不简并)
注意洪特规则是有特例的,这个特例考试经常考。电子填充状态为半充满,全充满时,原子比较稳定。三个电子填充三个轨道比四个电子填充三个轨道是要稳定的。
(看到这里了,尝试写出21~36号元素的电子价电子的轨道表示式吧!)
写完后,会发现有两个特例Cu、Cr,要特别注意它们的轨道表达式的书写。
必须指出,该规则只对基态原子或离子成立,激发态不谈洪特规则。(泡利不相容原理仍然适用)激发态时,电子会重新排布,重新成对,原子能量不是每个电子能量的叠加,我们追求的是原子能量最低,而不是每个电子能量最低(玄学doge)。

 更多
更多
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底