一、初中所学的核外电子排布规律
在初中时,我们都学习了核外电子排布规律,关于核外电子排布图有以下规则:
1.电子先填充内层,再填充外层。为什么呢?因为各层电子是有区别的,它们的能量并不相同:外层电子能量高,内层电子能量低。而我们大家都知道,我们要追求这个体系能量更低(更稳定)的话,就应该所有的电子都往能量更低的轨道上填充,这样整个体系的能量才会更低(更稳定)。
2.最内层最多两个电子,次外层最多八个电子,最外层最多八个电子。也就是说,如果最内层填充了三个电子,那么是错误的,次外层、最外层填充九个电子,也是错误的。
例如:

前18号元素(短周期元素)的核外电子排布图
由这个图像我们不难观察出,元素所在的周期数等于原子的电子层数(注意不是离子),主族序数等于原子最外层电子数(后来我们也将其称为价电子数),核电荷数等于质子数等于原子序数等于核外电子数。
(别光顾着看,来尝试写一下S离子的核外电子排布图吧!)
二、高中所学的核外电子排布规律
然而无论是科学理论,还是人的思想都是在不断发展进步的。高中所学的核外电子分布规律也更加复杂细致。首先我们需要学习的就是能层和能级的概念。
核外电子按能量不同分成能层。表示符号为K,L,M,N……电子的能层由内向外排序,能层越高,电子的能量越高,能量的高低顺序为
E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)
(对于高中生而言,记住前四项的字母排序即可)
同一能层的电子还被分成不同能级,能级的符号和所能容纳的最多电子数如下:
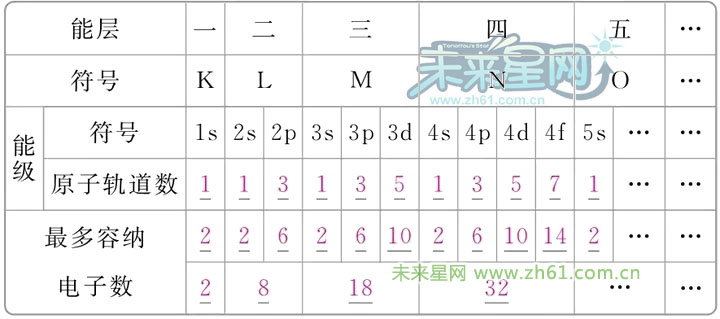
观察图像我们知道,任一能层的能级总是从s能级开始,能级数等于该能层序数,能级的符号总是s,p,d,f……排序的,字母前的数字是它们所处的能层序数,它们可容纳的最多电子数依次为自然数中的奇数数列1,3,5,7……的2倍(即2,6,10,14……)为什么要说1,3,5,7……的2倍,是因为每个原子轨道中最多容纳2个电子。1,3,5,7……实际是指原子轨道。
多电子原子中,同一能层各能级的能量顺序如下:
E(ns)<E(np)<E(nd)<E(nf)
综上,电子分布在原子轨道里,轨道组成能级,能级组成能层,能层组成核外电子分布。
注意:不要搞混KLMN和spdf。
说完了能层和能级,我们再来简单说一说原子轨道,原子轨道是电子填充的最小单位,刚刚介绍过每个轨道最多可容纳两个电子,而且这两个电子是自旋方向相反的。什么是自旋呢?它是微观粒子普遍存在的(像电荷、质量一样的)内在属性。最终容纳电子的不是能级,而是轨道,能级的作用是规定轨道的形状和能量大小。
首先来看看能级对形状的规定,s轨道是球形,p轨道是哑铃状的,具体如图

s电子的电子云轮廓图
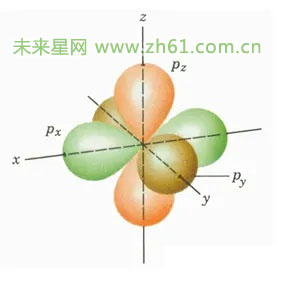
三个相互垂直的电子云
注意,同一原子的能层越高,s电子云半径越大,这是由于电子的能量逐渐升高,电子在离核更远的区域出现的概率逐渐增大。
介绍完了能级对轨道的形状的规定,下面是能级的第二个作用,对轨道能量的规定。这就要提到构造原理。以光谱学事实为基础,从氢开始,随核电荷数递增,新增的电子填入能级的顺序成为构造原理。
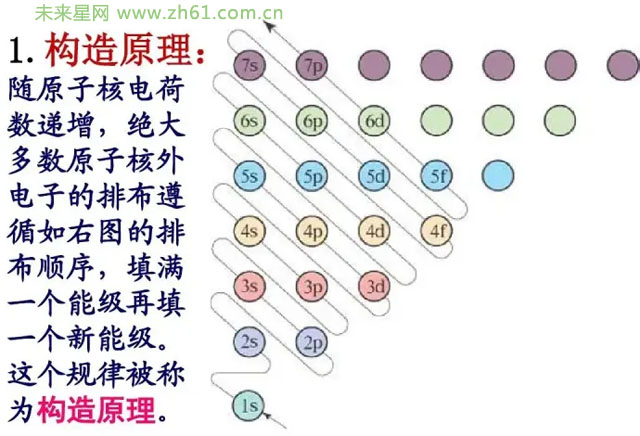
因为电子会优先填入低能量的轨道,所以由上可知各轨道的能量大小。所以我们发现4s的能量是低于3d的,这种电子层数较大的某些轨道其能量反而低于电子层数较小的某些轨道的现象叫作能级交错现象。
(但当原子失去电子变成离子时,会优先失去最外能层而不是能量最高的电子。)
应当指出,构造原理呈现的能级交错源于光谱学事实,是经验的,而不是任何理论推导的结果。构造原理是一个思维模型,是个假想过程。
说到这里,我们还要引入能级组的说法,它是能量相似的轨道组合,能级组:ns np (n-1)d (n-2)f
它的作用很大,我们将在后面的章节里讲到。
(来尝试写一下短周期元素的电子排布式吧!)
最后我们来介绍原子实和简化电子排布式,像He,Ne这样的稀有气体,它们内层的所有轨道都被填满,严严实实没有空隙,所以我们给它们取了一个名字——原子实,对于一个原子,我们都可以用它上一周期的稀有气体原子作为原子实,在原子实的基础上书写电子排布式,相当于是简化书写,如下:
Na的电子排布式1s^{2}2s^{2}2p^63s^1 ,用原子实简化书写[Ne]3s^1
抛去原子实,外面的这些电子就叫做价电子,大家可以发现,价电子是最大的一个能级组,并且价电子也是绝大多数参与反应得失的电子与显示元素价态的电子,所以研究价电子对我们确定元素性质有着重要意义。下一节,在【003】中,我们将进一步了解电子的基态和激发态。
看到这里了,真的不打算点个赞再走吗?

 更多
更多
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底